Reator Multipropósito Brasileiro
O Reator Multipropósito Brasileiro (RMB) é um empreendimento cuja execução está sob a responsabilidade da Comissão Nacional de Energia Nuclear (CNEN), por meio da Diretoria de Pesquisa e Desenvolvimento (DPD). O Reator Nuclear RMB será do tipo piscina aberta com potência máxima de 30 MW e terá como referência o Reator Nuclear OPAL de 20 MW, construído na Austrália, e projetado pela empresa argentina INVAP, a qual também participou do projeto básico do reator e dos sistemas do reator. O Centro de Engenharia Nuclear (CEN) constitui-se no maior parceiro técnico do Projeto RMB fornecendo expertise nas áreas de engenharia, licenciamento e apoio ao gerenciamento técnico das macro-atividades desenvolvidas até o momento (concepção de projeto, definicão do escopo do projeto básico, coordenação dos Relatório de Local e Relatório Preliminar de Análise de Segurança, e revisão do Relatório de Impacto Ambiental). Para as próximas etapas do Projeto RMB (definição do escopo do projeto executivo e acompanhamento dos Programas Básicos Ambientais), o CEN também estará envolvido na liderança e apoio institucional ao projeto.
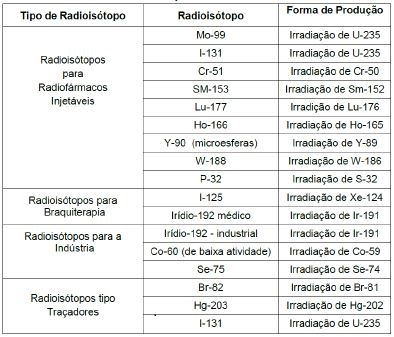
O Instituto de Pesquisas Energéticas e Nucleares (IPEN) é a unidade de pesquisa da CNEN responsável pela produção e distribuição de radioisótopos de origem em reatores nucleares e os radiofármacos que utilizam esses radioisótopos para uso em medicina nuclear. A própria história da medicina nuclear no Brasil é extremamente ligada a estas atividades do IPEN. O IPEN iniciou as atividades de produção de radioisótopos, para uso na Medicina Nuclear, no final de 1959, distribuindo a primeira partida de iodo-131(I-131), produzido no Reator Nuclear IEA-R1, para diagnóstico da função tireoidiana.
Ao longo dos anos, e com o avanço das técnicas diagnósticas e terapêuticas, novos radioisótopos produzidos em reator nuclear e seus radiofármacos foram incorporados à prática médica. Dentre eles destaca-se o gerador de molibdênio-99 (Mo-99), que fornece o radioisótopo mais utilizado em diagnóstico em medicina nuclear, o tecnécio-99m (Tc-99m), que marca facilmente uma série de conjuntos de reativos liofilizados (kits). Estes kits, marcados com Tc-99m, produzidos no IPEN, permitem a visualização e estudo dinâmico do funcionamento de uma série de órgãos e sistemas no corpo humano. O I-131 se estabeleceu para o diagnóstico e terapia de problemas relacionados à glândula tireoide. Moléculas marcadas com I-131, como a MIBG-I-131 e hipuran-I-131 permitem o diagnóstico e terapia de outras doenças. Moléculas marcadas com cromo-51 também foram incorporadas à produção rotineira do IPEN-CNEN/SP.
Mais recentemente, uma classe de radioisótopos emissores de partículas beta- se tornaram extremamente importantes em aplicações terapêuticas. Atualmente o IPEN-CNEN/SP produz radiofármacos preparados com samário-153, lutécio-177 e ítrio-90 (Y-90) para aplicações terapêuticas. Outros radioisótopos de interesse futuro para o preparo de radiofármacos, produzidos no RMB, são o hólmio-166 (Ho-166) e o rênio-188 (Re-188), na forma do gerador de tungstênio-188/rênio-188 (W-188-Re-188). Além deles, as micro-esferas marcadas com Ho-166, Y-90 e fósforo-32 (P-32) têm uso potencial em Medicina Nuclear. Hoje o P-32 é distribuído em 2 formas químicas diferentes para aplicações em pesquisas biológicas.
As radiações ionizantes são utilizadas também em diversas terapias, principalmente no tratamento de câncer. Nesse caso, a irradiação das células cancerosas tem o objetivo de destruí-las e impedir sua multiplicação. Uma das formas de aplicação da radiação consiste em se colocar pequenas fontes em contato direto com a área do tecido a ser irradiada (braquiterapia). Essas fontes podem ser aplicadas por um determinado período de tempo e depois retiradas – como é feito, por exemplo, em tratamentos de câncer de útero – ou ser implantadas no corpo do paciente, como no tratamento de câncer de próstata. Fios de irídio-192 e sementes de iodo-125 são processados no IPEN para este tipo de aplicação.
Destacam-se os seguintes itens relevantes para a definição conceitual do RBM:
* O Mo-99 e o I-131 são os principais radioisótopos para aplicação na saúde e devem ser a prioridade de irradiação no reator. Mo-99 e I-131 deverão ser produzidos a partir de alvos irradiados no núcleo do reator que consistem de placas combustíveis miniaturas (miniplacas), de liga de urânio-alumínio (UAl2) , revestidas de alumínio, sendo o urânio enriquecido a 20% em U-235. Cada alvo possui em torno de 1,4 gramas de U-235, sendo estimado um consumo semanal de 16 alvos para a atividade desejada de projeto. Os dispositivos de irradiação no reator e a unidade de processamento serão dimensionados para uma produção semanal mínima de 1.000 (um mil) curies de atividade de Mo-99, calibrados para após 6 dias de decaimento. (Observação: o consumo nacional atual do Mo-99 é de aproximadamente 450 curies de atividade por semana). Esta quantidade dobrará a oferta atual e também poderá ser incrementada, se houver necessidade, sem acarretar problemas técnicos ao projeto;
* O Mo-99 e I-131 são produtos de fissão do U-235, sendo necessárias células quentes para o processamento químico dos alvos irradiados e a separação/purificação desses radioisótopos, requerendo também frequência semanal de processamento e operação sem interrupção do reator por períodos de até 4 semanas;
* O radioisótopo I-125 para braquiterapia não exige alto fluxo de nêutrons, mas exige equipamentos específicos de irradiação e tratamento pós-irradiação, já que é produzido pela irradiação de um gás;
* A capacidade de produção dos demais radioisótopos para aplicação na saúde será definida conforme demanda existente e futura, não sendo este um parâmetro limitante ao projeto do reator e instalações associadas.Mo-99 e I-131 são produtos de fissão do U-235, sendo necessárias células quentes para o processamento químico dos alvos irradiados e a separação/purificação desses radioisótopos, requerendo também frequência semanal de processamento e operação sem interrupção do reator por períodos de até 4 semanas;
* O radioisótopo I-125 para braquiterapia não exige alto fluxo de nêutrons, mas exige equipamentos específicos de irradiação e tratamento pós-irradiação, já que é produzido pela irradiação de um gás;
* A capacidade de produção dos demais radioisótopos para aplicação na saúde será definida conforme demanda existente e futura, não sendo este um parâmetro limitante ao projeto do reator e instalações associadas.


